Beratung ISO 14971 Risikomanagement
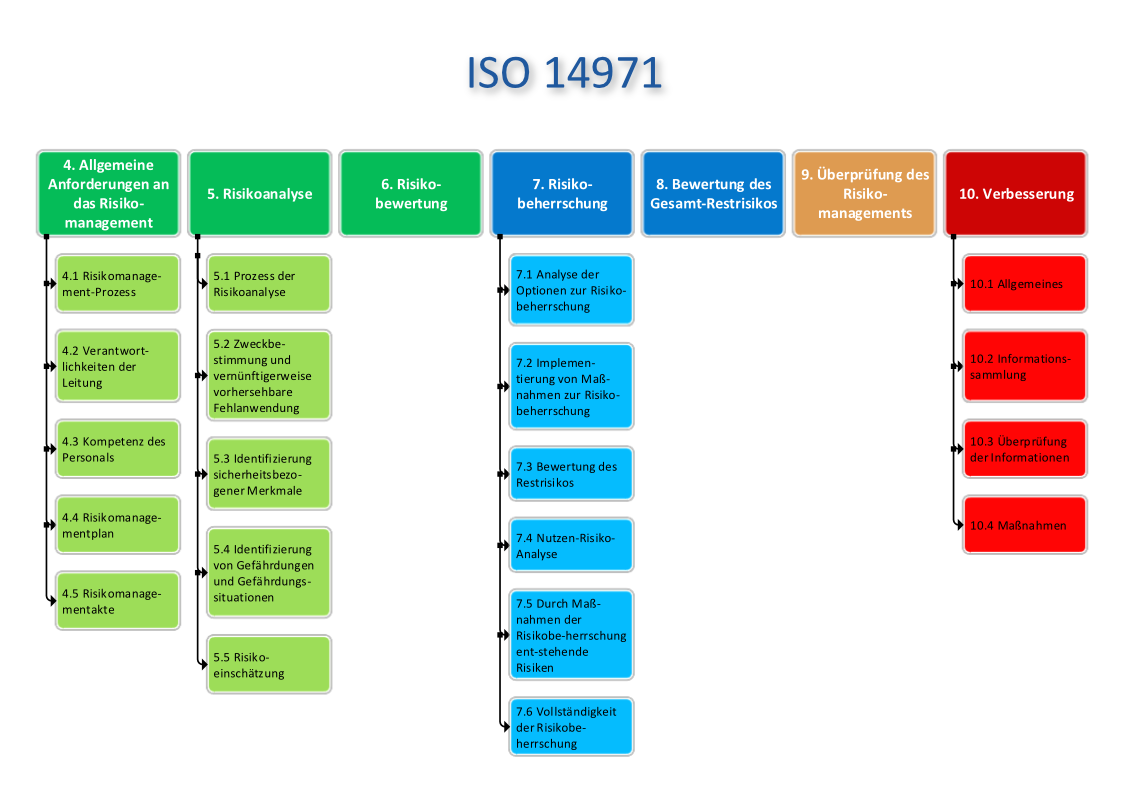
Das Risikomanagement für Medizinprodukte, geregelt durch die DIN EN ISO 14971, bildet die Grundlage für die Identifikation, Bewertung und Kontrolle von Risiken entlang des gesamten Produktlebenszyklus. Ob Entwicklung, Produktion oder Marktüberwachung – ein wirksames Risikomanagementsystem optimiert Prozesse und Produkte und trägt somit zur Sicherheit von Patienten bei. Nebenbei gewährleistet man die Einhaltung regulatorischer Anforderungen wie des Qualitätsmanagements ISO 13485 und der MDR.
Warum ist das Risikomanagement entscheidend?
Ein strukturiertes ISO 14971 Risikomanagement minimiert Gefahren, verbessert die Produktsicherheit und trägt zur Risikominimierung bei. Mit der richtigen Anwendung von Risikomanagement-Methoden lassen sich Risiken identifizieren, bewerten und minimieren sowie eine effektive Risikobewertung-Analyse durchführen. Diese Norm fordert zudem eine sorgfältige Dokumentation – von der Planung über die Durchführung bis zur Pflege der Risikomanagementakte gemäß ISO 14971 – um Prüfungen durch benannte Stellen erfolgreich zu bestehen.
Darüber hinaus ist das Risikomanagement ein zentraler Bestandteil der Technischen Dokumentation gemäß MDR Anhang II. Die Anforderungen der MDR unterstreichen die Bedeutung einer umfassenden und genauen Dokumentation, die sowohl die Sicherheit als auch die Einhaltung regulatorischer Vorgaben gewährleistet. Eine strukturierte Einführung der ISO 14971 stellt sicher, dass alle relevanten Prozesse normkonform umgesetzt werden.
Wir unterstützen Sie dabei:
- Einführung ISO 14971: Wir begleiten Sie durch den gesamten Implementierungsprozess und sorgen für eine regelkonforme Umsetzung.
- Erstellung von Risikomanagementplänen gemäß ISO 14971: Wir definieren Maßnahmen zur effektiven Risikobewältigung.
- Durchführung von Risikoanalysen: Mit bewährten Methoden wie der FMEA identifizieren wir potenzielle Gefährdungen, definieren Maßnahmen zur Risikominimierung oder -vermeidung und bewerten verbleibende Restrisiken.
- Pflege & Analyse Ihrer Risikomanagementakte: Wir sorgen für die regelmäßige Aktualisierung und lückenlose Dokumentation Ihrer Risikomanagement-Berichte.
- Bereitstellung von Vorlagen: Wir stellen praxisbewährte Vorlagen für Risikoanalysen und Risikobewertungsmatrizen zur Verfügung.
Mit unserer umfassenden Erfahrung in der Risikobewertung von Medizinprodukten bieten wir praxisorientierte und normkonforme Lösungen für Ihre individuelle Situation. Wir stellen sicher, dass Ihr Prozess des Risikomanagements effektiv und effizient umgesetzt wird. Wir unterstützen Sie bei jedem Schritt Ihres Prozesses des Risikomanagements. Kontaktieren Sie uns für eine unverbindliche Beratung.